Свойства аминокислот
- Общая информация о аминокислотах:
- Свойства отдельных аминокислот:
В 1900-1910 годах немецкий химик Эмиль Фишер доказал, что белок они сделаны из аминокислот, которые связаны с длинными цепями, называемыми полипептидными цепями.
Аминокислоты имеют две функциональные группы: аминогруппу -NH2 и карбоксильную группу -COOH. В зависимости от расположения аминогруппы можно различать α, β, γ, δ ι ε-аминокислоты.
Аминокислоты являются основным элементом белков. Отдельные аминокислоты соединяются друг с другом с помощью так называемых пептидная связь, возникающая в результате удаления группы ОН из карбоксильной группы и атома Н из аминогруппы с образованием одной молекулы воды. Соединение, состоящее из двух аминокислот, представляет собой дипептид . Трис и тетрапептиды образуются аналогичным образом, тогда как соединения, состоящие из многих аминокислот, называются полипептидами . Самые простые белки полипептиды с цепями, состоящими иногда из нескольких сотен аминокислот. Последующие атомы углерода в цепи, в которой находятся заместители (отсчет начинается с карбоновой группы), нумеруются с использованием арабских чисел. Иногда греческие буквы используются для обозначения, но тогда первая буква алфавита находится на атоме углерода, который связан, и на карбоксильной группе (не на атоме углерода, принадлежащем к карбоксильной группе). Простейшими представителями аминокислот являются глицин и аланин , Аминокислоты могут быть разделены из-за: типа углеводородного остатка и из-за количества амино или карбоксильных групп. Все аминокислоты, кроме глицина, являются оптически активными соединениями. Они имеют такую же конфигурацию, что и для L - (-) глицеринового альдегида.
В водном растворе аминокислоты диссоциируют с образованием иона цвиттериона при строго определенном рН. В растворе с pH = 7 (то есть нейтральным) аминокислоты находятся в форме цвиттерионов . Аминогруппа обладает положительным зарядом (NH3 +), а карбоксильная группа имеет отрицательный заряд (COO-). Эта форма называется цвиттерионом. Если pH среды, в которой находится аминокислота, изменяется, состояние ионизации молекул аминокислот также изменяется. Увеличение pH вызывает уменьшение концентрации ионов H +, и преобладает форма с неионизированной группой NH3. Когда pH уменьшается (увеличение концентрации H +), аминогруппа подвергается ионизации, в то время как карбоксильная группа принимает форму COOH.
Аминокислоты обладают амфотерными свойствами и образуют соли с кислотами и основаниями. Это кристаллические вещества, которые имеют высокие температуры плавления. Конденсация двух или более молекул аминокислот приводит к образованию пептидов. Характерная связь, которая возникает, когда две или более аминокислоты объединяются, является так называемой пептидная связь (-NH-CO-) Аминокислоты участвуют в биосинтезе многих соединений в клетках животных, в растениях и микроорганизмах.
Аминокислоты довольно хорошо растворяются в воде и других полярных растворителях (таких как спирты), в то время как они не растворяются в неполярных растворителях (то есть бензоле, эфире, углеводородах, например гексане).
В аминокислотах, а также в сахаре наблюдается явление оптической и структурной изомерии. По аналогии с сахарами следует ожидать среди аминокислот L и D и (+) и (-). Это связано с наличием хиральных центров в молекулах аминокислот (кроме глицина). Каждая аминокислота, за исключением глицина, может существовать в таких изомерных вариациях, отличающихся расположением в пространстве четырех заместителей, связанных с атомом углерода (альфа).
По характеру катаболических реакций аминокислоты подразделяются на: сахарообразующие (гликогенные), метаболизм сахара и кетогенные, обеспечивающие продукты, характерные для жирового обмена.
В природе существует чуть более двадцати аминокислот, как в форме свободных молекул, так и в виде более или менее сложных конденсатов. В основном это белки. В природных аминокислотных молекулах обе функциональные группы связаны с одним и тем же атомом углерода. Это так называемые α-аминокислоты. Синтетически также могут быть получены аминокислоты с различным расположением функциональных групп. Синтетические аминокислоты могут быть получены любым эффективным методом, наиболее распространенным методом является аммонолиз α-хлорзамещенных кислот или их сложных эфиров.
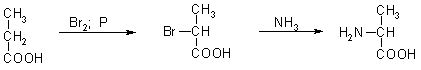
Синтетически полученные аминокислоты, конечно, являются рацематами, и для получения природных аминокислотных структур или субстратов для пептидного синтеза их следует разделить на энантиомеры, что является непростым или дешевым делом.
В промышленном масштабе аминокислоты получают в основном в процессе гидролиза соответствующим образом выбранных белков.
В организме человека вырабатывается около 300 граммов белка в день, хотя в среднем потребление белка составляет всего 70 граммов. Известно 21 аминокислота, из которых девять представляют собой экзогенные аминокислоты , то есть те, которые не могут вырабатываться организмом человека и должны содержаться в рационе. Напротив, эндогенные аминокислоты вырабатываются самим организмом на основе промежуточных продуктов углеводного обмена. Для человека эндогенными аминокислотами являются: аланин, глицин, пролин, гистидин, аргинин , аспарагиновая кислота, глутаминовая кислота и амидные эквиваленты этих кислот. Напротив, остальные аминокислоты являются незаменимыми аминокислотами (к ним относятся треонин, триптофан, фенилаланин , лизин лейцин, изолейцин, метионин).
Таким образом, среди белков мы можем выделить полезные белки, которые содержат все незаменимые аминокислоты и в количестве, достаточном для поддержания жизни. Такие белки содержатся в мясе, рыбе, молоке, сыре и яйцах. Вторая группа - это дефектные белки, которые являются ингредиентами овощей, зерна, семян и орехов. Они не содержат все экзогенные аминокислоты.
Все аминокислоты были известны до 1932 года. Аминокислоты являются кристаллическими твердыми веществами. Они хорошо растворяются в воде, почти растворяются в неполярных растворителях. Природные аминокислоты представляют собой α-аминокислоты. Основные структуры аминокислот, из которых состоит белок, содержат различные функциональные группы - кислотные, основные, ароматические кольца, спиртовые группы, атомы серы и т. Д. Характеристики отдельных аминокислот представлены ниже:
Глицин (Gly) - самая простая эндогенная аминокислота, которая является компонентом всех белков. Глицин является самой маленькой аминокислотой (его боковая цепь представляет собой просто атом водорода) и может быть найден в элементах, которые объединяют типичные белковые субструктуры. Значительные количества глицина присутствуют в склеропротеинах соединительной ткани и в фиброине шелка. В живом организме это бесплатный материал для синтеза многих соединений. Химическая формула для глицина может быть представлена следующим образом:
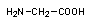
Аланин (Ala) эндогенная аминокислота; В природе встречается в двух изомерных вариантах: -аланин (встречается во многих белках, в плазме) и -аланин (встречается в дипептидах, ацетил-коферменте А и пантотеновой кислоте (витамин В2)). Аланин имеет полуструктурную формулу:
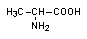
Валин (Val) - это экзогенная аминокислота, которая участвует в биосинтезе сахаров. У бактерий и растений он образуется из пировиноградной кислоты. Полуструктурная формула валина:
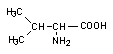
Lucyna (Leu), то есть 2-амино-4-метилпентановая кислота, (CH3) 2CH-CH2-CH (NH2) -COOH, представляет собой алифатическую аминокислоту, которая имеет разветвленную боковую цепь. Он входит в состав большинства белков и используется в медицине, биохимии и пищевой промышленности. Один из продуктов деградации лейцина в организме - ацилкофермент А является субстратом в биосинтезе стероидов.
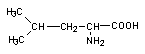
Изолейцин (Ile) имеет разветвленную углеродную цепь. Это экзогенная и электрически нейтральная аминокислота. Изолейцин характеризуется наличием двух оптически активных центров. Полуструктурная формула изолейцина показана ниже:
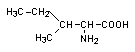
Серин (Ser) является эндогенной аминокислотой, которая входит в состав белков, таких как казеин фиброин молока или шелка. Это также компонент некоторых фосфолипидов. Серин участвует в биосинтезе сфингозина (дигидроксиаминоспирта с одной двойной связью в цепи из 18 атомов углерода) и многих аминокислот; является частью активного центра многих ферментов. Производные серина - азазерин и циклосерин - являются антибиотиками. Серин имеет химическую формулу:
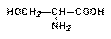
Треонин (Thr) присутствует в небольших количествах в большинстве белков (в дополнение к протамину). Это экзогенная аминокислота. У него два асимметричных атома углерода. У растений и микроорганизмов он образуется из аспарагина. У некоторых организмов он участвует в биосинтезе изолейцина. Это первая известная экзогенная аминокислота.
Цистеин (Cys) является эндогенной аминокислотой, содержащей тиоловую группу -SH, благодаря которой он способен образовывать сульфидные мостики (в обратимой форме) - один из факторов, влияющих на вторичную структуру белков. Это общий компонент белков. Цистеин выполняет защитные функции организма, связывая многие токсичные вещества (например, ионы тяжелых металлов, соединения мышьяка, цианиды, ароматические углеводороды). Он также принадлежит к активным центрам многих ферментов и играет важную роль в синтезе кератина - белка, который содержится в коже, волосах и ногтях. Цистеин также является компонентом коэнзима А и глутатиона. Из двух молекул цистеина цистин ( Cys-SS-Cys), содержащий дисульфидную связь, образуется при дегидрировании. Эта обратимая реакция имеет большое значение в формировании пространственной структуры белков и образовании оксидоредуктивных систем в клетке. Полуструктурная формула цистина:
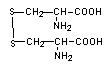
Фенилаланин (Phe) является экзогенной аминокислотой, которая входит в состав большинства белков. Фенилаланин является важным компонентом белков в организме человека, поэтому он не может отсутствовать в организме. Люди с генетическим дефектом фенилкетонурии (ПКН) не могут метаболизировать фенилаланин. Это приводит к опасно высоким уровням фенилаланина в мозге (иногда смертельным). Аминокислотный фенилаланин содержится в продуктах, содержащих много белка, таких как мясо, яйца, рыба, молоко, сыр и (в меньших количествах) в зерновых продуктах, овощах и фруктах. Из фенилаланина в нашем организме образуется другая аминокислота - тирозин. фенилкетонурия генетически обусловленное нарушение обмена веществ Без надлежащего и быстрого лечения (которое в данном случае зависит от правильного питания) накопление значительных количеств фенилаланина приводит к прогрессирующему повреждению головного мозга.
Триптофан (Try) является ароматической, экзогенной аминокислотой. Он является компонентом многих белков и содержится в высоких концентрациях в некоторых антибиотиках. Дефицит этой аминокислоты у людей и животных снижает сопротивляемость организма. Это также может привести к недоразвитию. В триптофане образуются растения алкалоиды Индиго и гетероауксин. У насекомых трансформация триптофана приводит к образованию глазных пигментов. У позвоночных триптофан может частично превращаться в никотиновую кислоту и ее амид (компонент НАД и НАДФ) и, после присоединения гидроксильной группы, к исходному веществу серотонину. серотонин является тканевым гормоном, вырабатываемым в слизистой оболочке кишечника, тромбоцитах, центральной нервной системе. Этот гормон участвует в регуляции кровяного давления, свертываемости крови и функций центральной нервной системы.
Тирозин (Tyr) представляет собой ароматическую аминокислоту, которая образуется в результате экзогенной трансформации фенилаланинов животных. Тирозин является основным веществом среди нейротрансмиттеров - веществ, которые отвечают за проведение стимулов в нервной системе. Эта аминокислота превращается организмом в дофамин и норадреналин, которые передают стимулы синапсам, то есть местам контакта и соединениям нервных клеток. Дофамин оказывает значительное влияние на половое влечение. норадреналин это влияет на самочувствие и производительность памяти мозга. Высокий уровень тирозина вызывает состояние физической и эмоциональной готовности и жизненной силы. Тирозин также проявляет анаболический эффект, ускоряет потерю подкожного жира, одновременно вызывая увеличение силы и мышечной массы. Нарушение тирозина приводит к серьезному заболеванию - алкаптонурии. алкаптонурия приводит к воспалению суставов и сухожилий. Алкаптонурия является редким заболеванием, вызванным врожденным дефицитом гомогентизиноксидазы. Симптомами этого заболевания являются потемнение мочи и защита.
Пролин (Pro) - это аминокислота, необходимая для образования коллагена. Является эндогенной аминокислотой с гетероциклической структурой. Эта аминокислота содержится в большом количестве в белках соединительной ткани и в протеиназах растительных белков.
Лизин (Lys) является неполярной аминокислотой. Эта основная эндогенная аминокислота содержится в гистоновых белках и протаминах. В результате действия бактериальных ферментов из лизина образуется очень токсичный кадаверин (биогенный амин, маслянистое вещество, повреждающее систему кровообращения, яд трупа). Лизин необходим для роста, обновления тканей, выработки антител, гормонов и ферментов, способствует улучшению умственной концентрации, влияет на правильное использование жирных кислот.
Аргинин (Arg) является эндогенной основной аминокислотой, которая является общим компонентом белков. Большое количество аргинина содержится в белках ядер клеток. Аргинин является основным компонентом, вовлеченным в цикл мочевины; в процессе приготовления токсичного аммиака для безопасного выведения почками. Аргинин используется для сбора и переноса азота в живом организме. Она участвует в цикле Кребса.
Гистидин (His) является эндогенной основной аминокислотой. В инертной среде лизин и аргинин имеют положительный заряд, тогда как гистидин может легко проходить между положительной и инертной нагрузкой. Это свойство используется в центрах активных ферментов, где гистидин, изменяя зарядовые состояния, катализирует образование и разрыв связей. Аминокислота легко декарбоксилируется. Он является предшественником гистамина, сосудорасширяющим и стимулирует желудочный сок.
Аспарагиновая кислота (Asp ) является компонентом многих белков, особенно растительных. Эта кислота является эндогенной аминокислотой. Он участвует в синтезе пуринов, пиримидинов и аргинина. Эта аминокислота кислая.
Глютамин (Glu) является эндогенной аминокислотой, которая является компонентом растительных и животных организмов. В мышцах человека много глютамина - это более 50% аминокислот, присутствующих в мышечных клетках. Это предшественник в синтезе почти всех эндогенных аминокислот. Способность организма вырабатывать глютамин, хотя и в ограниченном количестве, делает его принадлежащим к так называемым эндогенным аминокислотам. Глютамин нуждается в мозге, иммунной системе, пищеварительном тракте и мышцах, а также способствует приобретению силы и мышечной массы. L-глютамин содержится почти во всех белках. Особенно большие количества содержат глиадин (31%), казеин (24%), сывороточный белок (7%), белок из кукурузы и сои (6%). Кислый глутамат натрия часто используется в качестве пряности. Глутамат натрия - это соль глутаминовой кислоты. Это широко распространенная безвредная пищевая добавка, значительно улучшающая вкус и запах блюд. Свободный глютамин является хранилищем аммиака, который образуется в результате превращения аминокислот.
С точки зрения химии, L-глютамин и глутаминовая кислота являются очень похожими веществами, которые подвергаются взаимному превращению в организме. Глутаминовая кислота является эндогенной аминокислотой. Это единственная аминокислота, синтезируемая растениями и животными непосредственно из свободного аммиака и α- кетоглутаровой кислоты. Эта кислота используется для лечения заболеваний, связанных с повреждением нервной системы, например, болезни Генриха-Медина, невротических состояний и туберкулезного менингита.